Les épizooties de peste aviaire rapportées dans le monde depuis l'identification de ces virus aviaires en 1955 ont été très sporadiques : entre 1955 et 2004, un total de 25 épizooties de peste aviaire a été enregistré principalement chez le poulet et la dinde alors qu'une seule a été déclarée chez des oiseaux sauvages (Tableau I) [2].
La France n'a jamais été touchée. De 1959 à 1999, près de 23 millions d'oiseaux ont été concernés pour toutes ces épizooties ayant sévi sur 40 ans alors que, depuis 1999, on a pu observer des épizooties meurtrières et plus fréquentes où plus de 200 millions d'oiseaux ont été éliminés en cinq ans.
En Europe, il y a eu des épizooties italiennes et hollandaise. L’Italie a connu plusieurs épizooties : la première, en 1997 était due à un virus H5N2. La seconde, due à un virus H7N1 en 1999, fut plus meurtrière avec près de 14 millions d’oiseaux abattus (et un coût de 200 millions d’euros). L’épizootie hollandaise de 2003, due à un virus H7N7, fut plus meurtrière avec 30 millions d’oiseaux morts ou abattus (soit le tiers de la population des volailles hollandaises), avec la contamination la même année de la Belgique (8 foyers) et de l'Allemagne (1 foyer).
L’épizootie de peste aviaire qui a enflammé le sud-est asiatique a vraisemblablement débuté en Chine, puis a touché la Thaïlande. Ces deux pays, principaux exportateurs de volailles, ont contaminé les autres pays du Sud Est-asiatique en 2003 à la suite d'échanges commerciaux.
Les oiseaux migrateurs ont souvent été incriminés pour expliquer la propagation du virus à partir de juillet 2005 vers la Mongolie, le Kazakhstan, puis la Russie jusqu'à la Roumanie la Turquie, la Croatie et l'Ukraine. Bien que le rôle des oiseaux migrateurs ne soit pas toujours prouvé, l’Union Européenne a recommandé par mesure de précaution, le confinement des élevages "plein air" en octobre 2005.
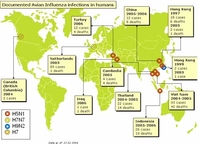
Un autre risque difficile à estimer mais non négligeable concerne l'importation frauduleuse des oiseaux de compagnie à partir de pays contaminés. La première alerte eut lieu à l'aéroport de Bruxelles en Belgique avec la détection du virus IAHP H5N1 asiatique chez deux aigles (Spizaetus nipalis), apparemment sains, importés illégalement de Thaïlande en octobre 2004.
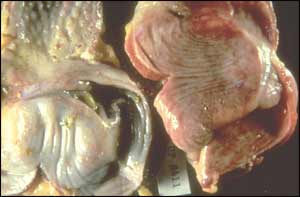
Cependant l'autopsie de ces aigles permit d'observer une entérite chez les deux oiseaux associée chez l'un d'entre eux à une pneumonie [3].
Le second cas de contamination d'oiseaux de compagnie a concerné des canaris morts en quarantaine au Royaume-Uni (avec isolement du virus H5N1). Ces canaris provenaient a priori de Taiwan en octobre 2005 alors que ce pays n'a été atteint que par un virus IAHP H5N2. En fait, cet exemple montre surtout la difficulté de connaître la traçabilité des oiseaux lors d'échanges commerciaux. Cet épisode britannique a, d’ailleurs, justifié un renforcement des mesures d’importation des oiseaux de compagnie en Europe.